Até o final do século XVIII, aproximadamente, o homem só sabia utilizar a energia que vinha da natureza, como carros de bois, moinhos, barcos a vela, desníveis de rios, entre outras formas usadas como fonte de energia. Mas a partir desta época, com a criação da máquina a vapor, foram revolucionados os transportes terrestre e marítimo, com as locomotivas e navios a vapor, e também as produções nas fábricas.
Apenas no século XX, quando as máquinas elétricas tomaram espaço, as máquinas a vapor diminuíram suas funções, mas ainda possuem aplicações úteis nos dias atuais. Isso demosntra a importância do estudo das transformações gasosas, não apenas para um maior entendimento dos processos termodinâmicos, mas também para aplicações nos processos mecânicos e industriais.
As máquinas térmicas caracterizam-se pela transformação de energia térmica em mecânica, por meio do aquecimento de um gás. Sólidos e líquidos não são utilizados em máquinas térmicas, pois ambos possuem uma dilatação muito pequena se comparada com a dos gases.
Esta transformação de energia térmica em mecânica pode ser exemplificada na experiência a seguir, cuja dinâmica envolve três variáveis importantes nas transformações gasosas: temperatura, pressão e volume.
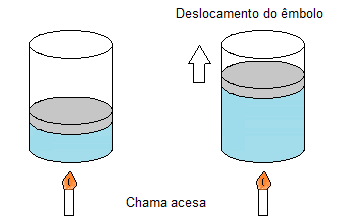
Figura 1. O aquecimento de um gás causa o deslocamento do êmbolo.
Observe na figura 1 que, com a chama acesa, há um aumento da temperatura, provocando uma maior agitação das moléculas e, consequentemente, aumento da pressão nas paredes do recipiente pelos choques das partículas. O êmbolo, por estar solto, começa a subir pela maior pressão, aumentando o volume. Um gás não tem forma nem volume definidos, por isso ocupa o volume que lhe for dado. No caso do experimento, se o êmbolo sobe, o gás ocupará o volume extra gerado.
A pressão é a força pela área, ou seja,
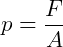
onde força é dada em Newtons (N), a área em metros quadrados (m²) e a pressão em Pascal (Pa), com 1 Pa = N/m².
A pressão pode aparecer em atmosferas (atm) ou milímetros de mercúrio (mmHg), veja a seguir as relações
1 atm = 760 mmHg = 105 Pa
No estudo das transformações gasosas será considerado, normalmente, o gás perfeito. Um gás é considerado perfeito quando podemos desprezar as forças de ligação entre suas partículas. Quanto mais rarefeito ou aquecido um gás, mais perfeito ele é, visto que as partículas estão mais afastadas umas das outras, diminuindo a força de ligação.
Os gases perfeitos possuem uma equação característica, relacionando as três grandezas já citadas: temperatura, volume e pressão. É a chamada Equação de Clapeyron, definida como
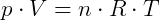
onde
- p é a pressão
- V é o volume (em Litros, L)
- T é a temperatura (em Kelvin, K)
- n é o número de mols
- R é a constante universal dos gases perfeitos (R = 0,082 atm.L/mol.K, nas CNTP).
Haverá uma transformação gasosa quando pelo menos uma das variáveis de estado do gás se altera. Contudo, pela Equação de Clapeyron, verificamos que se uma variável sofre alteração, pelo menos uma outra deve se alterar também. Assim, destacam-se as seguintes transformações gasosas:
- Isotérmicas: o volume e a pressão variam, a temperatura permanece constante;
- Isobáricas: a temperatura e o volume variam, a pressão é constante;
- Isovolumétricas (ou Isocóricas): a pressão e a temperatura variam, mas o volume é constante.
Ainda existem as transformações adiabáticas, que ocorrem sem a troca de calor com o meio externo.
The post Transformações gasosas appeared first on InfoEscola.
InfoEscola https://ift.tt/2CyP8Dz
Publicado primeiro em https://www.infoescola.com"
Nenhum comentário:
Postar um comentário