Há um comparativo didático entre as três leis da termodinâmica:
- 1ª Lei: não se pode ganhar;
- 2ª Lei: não se pode nem empatar;
- 3ª Lei: pode-se empatar somente no zero absoluto.
Em outras palavras, a primeira lei define que a energia apenas se transforma de uma forma em outra, não podendo criá-la, daí o expressão "não se pode ganhar". A segunda lei afirma que além de não poder ganhar (criar energia), ainda se perde uma parte, pois não é possível transformar toda ela em trabalho, por isso a expressão "nem empatar".
Já a terceira lei da termodinâmica afirma que no zero absoluto é possível que uma máquina tenha rendimento 100%, ou seja, a energia térmica, em forma de calor, pode ser totalmente transformada em trabalho, sem perdas. Por isso foi afirmado que no zero absoluto pode haver um "empate", pois não se cria energia, mas também não se perde, pois é transformada em sua totalidade.
No zero absoluto, a energia interna do corpo é nula, não havendo nenhum movimento molecular. Pela Primeira Lei da Termodinâmica:
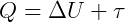
como ΔU = 0,
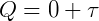
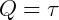
o calor seria totalmente transformado em trabalho.
Contudo, o zero absoluto nunca foi atingido em laboratório, o que faz com que a hipótese da terceira lei seja apenas teórica quando a temperatura é exatamente igual a zero. Entretanto, não foram eliminadas as hipótese para situações em que a temperatura se aproxima do zero absoluto.
Em 1907, Walther Nernst (1864-1941) propôs uma lei que tratava dessas situações, em que a temperatura se aproxima do zero absoluto:
"A entropia do sistema tende a zero se a sua temperatura tende a zero."
Esta lei de Nernst ficou conhecida como a Terceira Lei da Termodinâmica.
Max Planck (1858-1947) também chegou a resultados idênticos, contudo considera a entropia nula, no zero absoluto, apenas para substâncias puras, e não para misturas.
A entropia mede o nível de desorganização molecular do sistema. Quanto maior a temperatura, maior a entropia, pois as moléculas, mais aquecidas, se movimentam mais e tendem a se espalhar no volume. Com o conceito de entropia, a Segunda Lei da Termodinâmica também pode ser escrita da seguinte forma:
"Se um processo ocorre em um sistema fechado, a entropia nunca diminui, permanecendo constante para processos reversíveis, ou aumentando, para processos irreversíveis."
Processos reversíveis podem voltar ao seu estado inicial, enquanto que os irreversíveis não. Um exemplo prático é quando se coloca uma gota de água em uma chapa quente, de forma que esta sofra uma calefação. Dificilmente a gota voltará ao seu estado inicial, sendo este processo irreversível. Já um recipiente com água, ao ser resfriado, torna-se um volume de gelo, mas se aquecido, pode voltar a ser líquido novamente, sendo um processo reversível.
No contexto das três leis, sendo impossível ter uma máquina térmica com 100% de eficiência, considera-se um processo reversível o processo ideal pelo qual é obtido eficiência máxima em uma máquina térmica, mesmo que ainda se tenha η < 1.
Destacam-se alguns fatores que fazem um processo se tornar irreversível, como reações químicas espontâneas, fricção em deslizamentos ou em escoamento de fluidos, expansão de gases ou líquidos para uma pressão menor sem que haja resistência, deformação inelástica, fluxo de corrente elétrica em resistências, transferências de calor em sistemas com diferença de temperaturas finita, entre outros.
The post Terceira lei da termodinâmica appeared first on InfoEscola.
InfoEscola https://ift.tt/2XUVwhs
Publicado primeiro em https://www.infoescola.com"
Nenhum comentário:
Postar um comentário